تعامل و ساختار mRNA، tRNA، RRNA - سه اسید نوکلئیک اصلی - مورد توجه علم سیتولوژی است. این کمک خواهد کرد تا بفهمیم نقش انتقال (tRNA) در سلول ها چیست. این مولکول بسیار کوچک، اما در عین حال غیرقابل انکار مهم در فرآیند ترکیب پروتئینهای سازنده بدن شرکت میکند.
ساختار tRNA چیست؟ بسیار جالب است که به این ماده "از درون" نگاه کنیم تا بیوشیمی و نقش بیولوژیکی آن را دریابیم. و همچنین، ساختار tRNA و نقش آن در سنتز پروتئین چگونه به هم مرتبط هستند؟
tRNA چیست، ساختار آن چگونه است؟
اسید ریبونوکلئیک حمل و نقل در ساخت پروتئین های جدید نقش دارد. تقریباً 10٪ از تمام اسیدهای ریبونوکلئیک اسیدهای انتقالی هستند. برای اینکه مشخص شود این مولکول از چه عناصر شیمیایی تشکیل شده است، ساختار ساختار ثانویه tRNA را شرح خواهیم داد. ساختار ثانویه تمام پیوندهای شیمیایی اساسی بین عناصر را در نظر می گیرد.
متشکل از یک زنجیره پلی نوکلئوتیدی. بازهای نیتروژنی موجود در آن توسط پیوندهای هیدروژنی به هم متصل شده اند. RNA نیز مانند DNA دارای 4 باز نیتروژن است: آدنین، سیتوزین، گوانین و اوراسیل. در این ترکیبات آدنین همیشه با اوراسیل و گوانین طبق معمول با سیتوزین همراه است.
چرا یک نوکلئوتید پیشوند ریبو- دارد؟ به سادگی، تمام پلیمرهای خطی که در پایه نوکلئوتید به جای پنتوز دارای ریبوز هستند، ریبونوکلئیک نامیده می شوند. و RNA انتقالی یکی از 3 نوع پلیمر ریبونوکلئیک است.
ساختار tRNA: بیوشیمی
بیایید به عمیق ترین لایه های ساختار مولکول نگاه کنیم. این نوکلئوتیدها دارای 3 جزء هستند:
- ساکارز، همه انواع RNA شامل ریبوز هستند.
- اسید فسفریک.
- نیتروژن و پیریمیدین.

پایه های نیتروژنی توسط پیوندهای قوی به یکدیگر متصل می شوند. مرسوم است که بازها را به پورین و پیریمیدین تقسیم می کنند.
پورین ها آدنین و گوانین هستند. آدنین مربوط به یک آدنیل نوکلئوتید از 2 حلقه به هم پیوسته است. و گوانین مربوط به همان نوکلئوتید گوانین "تک حلقه" است.
پیرامیدین ها سیتوزین و اوراسیل هستند. پیریمیدین ها دارای یک ساختار حلقه واحد هستند. تیمین در RNA وجود ندارد، زیرا با عنصری مانند اوراسیل جایگزین می شود. درک این موضوع قبل از توجه به سایر ویژگی های ساختاری tRNA مهم است.
انواع RNA
همانطور که می بینید، ساختار tRNA را نمی توان به طور خلاصه توضیح داد. برای درک هدف مولکول و ساختار واقعی آن باید در بیوشیمی کاوش کرد. چه نوکلئوتیدهای ریبوزومی دیگری شناخته شده است؟ همچنین اسیدهای نوکلئیک ماتریکس یا اطلاعات و ریبوزومی وجود دارد. به اختصار mRNA و RRNA نامیده می شود. هر 3 مولکول در سلول با هم کار می کنند تا اطمینان حاصل شود که بدن گلبول های پروتئینی با ساختار مناسب را دریافت می کند.

تصور کار یک پلیمر بدون کمک 2 پلیمر غیر ممکن است. ویژگیهای ساختاری tRNA زمانی واضحتر میشود که در ارتباط با عملکردهایی که مستقیماً با کار ریبوزومها مرتبط هستند در نظر گرفته شوند.
ساختار mRNA، tRNA و RRNA از بسیاری جهات مشابه است. همه در پایه خود ریبوز دارند. با این حال، ساختار و عملکرد آنها متفاوت است.
کشف اسیدهای نوکلئیک
یوهان میشر سوئیسی در سال 1868 ماکرومولکول هایی را در هسته سلول کشف کرد که بعدها نوکلئین نامیده شدند. نام "نوکلئین" از کلمه (هسته) - هسته گرفته شده است. اگرچه کمی بعد مشخص شد که در موجودات تک سلولی که هسته ندارند، این مواد نیز وجود دارند. در اواسط قرن بیستم، او جایزه نوبل را برای کشف سنتز اسیدهای نوکلئیک دریافت کرد.
در سنتز پروتئین
خود نام - RNA انتقالی - در مورد عملکرد اصلی مولکول صحبت می کند. این اسید نوکلئیک اسید آمینه ضروری مورد نیاز RNA ریبوزومی برای ایجاد یک پروتئین خاص را با خود می آورد.
مولکول tRNA عملکرد کمی دارد. اولین مورد شناسایی کدون mRNA است، عملکرد دوم تحویل بلوک های ساختمانی - اسیدهای آمینه برای سنتز پروتئین است. برخی دیگر از کارشناسان عملکرد پذیرنده را برجسته می کنند. یعنی افزودن اسیدهای آمینه بر اساس اصل کووالانسی. آنزیمی مانند آمینوسیل-TRNA سنتاتاز به "چسبیدن" این اسید آمینه کمک می کند.
ساختار tRNA چه ارتباطی با عملکردهای آن دارد؟ این اسید ریبونوکلئیک مخصوص به گونه ای طراحی شده است که در یک طرف آن پایه های نیتروژنی وجود دارد که همیشه به صورت جفت به هم متصل هستند. اینها عناصری هستند که برای ما شناخته شده است - A، U، C، G. دقیقاً 3 "حرف" یا پایه نیتروژنی یک آنتی کدون را تشکیل می دهند - مجموعه معکوس عناصری که بر اساس اصل مکمل بودن با کدون تعامل دارند.
این ویژگی مهم ساختار tRNA تضمین می کند که هنگام رمزگشایی اسید نوکلئیک الگو هیچ خطایی وجود نخواهد داشت. از این گذشته، توالی دقیق اسیدهای آمینه تعیین می کند که آیا پروتئین مورد نیاز بدن به درستی سنتز شده است یا خیر.
ویژگی های ساختاری
ویژگی های ساختاری tRNA و نقش بیولوژیکی آن چیست؟ این یک سازه بسیار قدیمی است. ابعاد آن چیزی بین 73 تا 93 نوکلئوتید است. وزن مولکولی این ماده 25000-30000 است.
ساختار ساختار ثانویه tRNA را می توان با مطالعه 5 عنصر اصلی مولکول تجزیه و تحلیل کرد. بنابراین، این اسید نوکلئیک از عناصر زیر تشکیل شده است:
- حلقه برای تماس با آنزیم؛
- حلقه برای تماس با ریبوزوم؛
- حلقه آنتی کدون؛
- ساقه پذیرنده;
- خود آنتی کدون
و همچنین یک حلقه متغیر کوچک را در ساختار ثانویه جدا می کنند. یک بازوی همه انواع tRNA یکسان است - یک ساقه از دو باقی مانده سیتوزین و یک باقی مانده آدنوزین. در این مرحله است که ارتباط با 1 اسید آمینه از 20 اسید آمینه موجود رخ می دهد. هر اسید آمینه آنزیم خاص خود را دارد، آمینواسیل-tRNA مخصوص به خود.

تمام اطلاعاتی که ساختار همه افراد را رمزگذاری می کند در خود DNA موجود است. ساختار TRNA در تمام موجودات زنده روی این سیاره تقریباً یکسان است. هنگامی که به صورت دو بعدی مشاهده می شود مانند یک برگ به نظر می رسد.
با این حال، اگر نگاهی سه بعدی داشته باشید، مولکول شبیه یک ساختار هندسی L شکل است. این ساختار سوم tRNA در نظر گرفته می شود. اما برای سهولت مطالعه، مرسوم است که آن را به صورت بصری "باز کردن" کنید. ساختار سوم در نتیجه تعامل عناصر ساختار ثانویه شکل می گیرد، آن بخش هایی که مکمل یکدیگر هستند.
بازوها یا حلقه های TRNA نقش مهمی دارند. به عنوان مثال، یک بازو برای پیوند شیمیایی با یک آنزیم خاص مورد نیاز است.
یکی از ویژگی های یک نوکلئوتید وجود تعداد زیادی نوکلئوزید است. بیش از 60 نوع از این نوکلئوزیدهای کوچک وجود دارد.
ساختار TRNA و کدگذاری اسید آمینه
می دانیم که آنتی کدون tRNA 3 مولکول طول دارد. هر آنتی کدون مربوط به یک اسید آمینه "شخصی" خاص است. این اسید آمینه با استفاده از یک آنزیم خاص به مولکول tRNA متصل می شود. به محض ترکیب 2 اسید آمینه، پیوند با tRNA شکسته می شود. تمام ترکیبات شیمیایی و آنزیم ها قبل از زمان لازم مورد نیاز هستند. به این ترتیب ساختار و عملکرد tRNA به هم مرتبط می شود.
در مجموع، 61 نوع از این مولکول ها در سلول وجود دارد. ممکن است 64 تغییر ریاضی وجود داشته باشد، با این حال، 3 نوع tRNA وجود ندارد، زیرا دقیقاً همان تعداد کدون توقف در mRNA آنتی کدون ندارند.
تعامل mRNA و tRNA
اجازه دهید تعامل ماده با mRNA و RRNA و همچنین ویژگی های ساختاری tRNA را در نظر بگیریم. ساختار و هدف یک ماکرومولکول به هم مرتبط هستند.
ساختار mRNA اطلاعات را از بخش جداگانه ای از DNA کپی می کند. DNA به خودی خود ترکیبی از مولکول ها بسیار بزرگ است و هرگز از هسته خارج نمی شود. بنابراین، ما به RNA واسطه – RNA اطلاعاتی نیاز داریم.

بر اساس توالی مولکول هایی که mRNA کپی کرده است، ریبوزوم یک پروتئین می سازد. ریبوزوم یک ساختار پلی نوکلئوتیدی جداگانه است که ساختار آن باید روشن شود.
tRNA ریبوزومی: تعامل
RNA ریبوزومی یک اندامک بزرگ است. وزن مولکولی آن 1,000,000 - 1,500,000 است تقریباً 80 درصد از کل مقدار RNA نوکلئوتیدهای ریبوزومی است.

به نظر می رسد که زنجیره mRNA را می گیرد و منتظر آنتی کدون هایی است که مولکول های tRNA را با خود می آورند. RNA ریبوزومی از 2 زیر واحد کوچک و بزرگ تشکیل شده است.
ریبوزوم "کارخانه" نامیده می شود زیرا تمام سنتز مواد لازم برای زندگی روزمره در این اندامک انجام می شود. این نیز یک ساختار سلولی بسیار قدیمی است.
چگونه سنتز پروتئین در ریبوزوم اتفاق می افتد؟
ساختار tRNA و نقش آن در سنتز پروتئین به هم مرتبط هستند. آنتی کدون واقع در یک طرف اسید ریبونوکلئیک از نظر شکل مناسب برای عملکرد اصلی آن است - تحویل اسیدهای آمینه به ریبوزوم، جایی که ساخت تدریجی پروتئین اتفاق می افتد. در اصل، tRNA به عنوان یک واسطه عمل می کند. وظیفه آن فقط آوردن اسید آمینه لازم است.
هنگامی که اطلاعات از یک قسمت mRNA خوانده می شود، ریبوزوم بیشتر در طول زنجیره حرکت می کند. ماتریس فقط برای انتقال اطلاعات رمزگذاری شده در مورد پیکربندی و عملکرد یک پروتئین فردی مورد نیاز است. سپس، tRNA دیگری با پایه های نیتروژنی خود به ریبوزوم نزدیک می شود. همچنین قسمت بعدی mRNA را رمزگشایی می کند.
رمزگشایی به صورت زیر انجام می شود. بازهای نیتروژنی بر اساس اصل مکمل بودن به همان روشی که در خود DNA وجود دارد ترکیب می شوند. بر این اساس، TRNA میبیند که باید به کجا ببندد و به کدام سوله آمینو اسید ارسال کند.

سپس در ریبوزوم، آمینو اسیدهای انتخاب شده به این روش پیوند شیمیایی پیدا می کنند، مرحله به مرحله یک ماکرومولکول خطی جدید تشکیل می شود که پس از اتمام سنتز، به شکل یک گلبول (توپ) پیچ خورده است. tRNA و mRNA مورد استفاده، با انجام عملکرد خود، از "کارخانه" پروتئین حذف می شوند.
هنگامی که قسمت اول یک کدون با یک آنتی کدون جفت می شود، یک چارچوب خواندن تعیین می شود. پس از آن، اگر به دلایلی تغییر قاب رخ دهد، برخی از ویژگی های پروتئین رد می شوند. ریبوزوم نمی تواند در این فرآیند مداخله کند و مشکل را حل کند. تنها پس از تکمیل فرآیند، 2 زیر واحد RRNA دوباره به هم می رسند. به طور متوسط به ازای هر 104 اسید آمینه 1 خطا وجود دارد. به ازای هر 25 پروتئینی که قبلاً جمع آوری شده اند، حداقل 1 خطای تکرار وجود دارد.
TRNA ها به عنوان مولکول های باقی مانده
از آنجایی که tRNA ممکن است در زمان پیدایش حیات روی زمین وجود داشته باشد، به آن مولکول باقی مانده می گویند. اعتقاد بر این است که RNA اولین ساختاری است که قبل از DNA وجود داشته و سپس تکامل یافته است. فرضیه جهان RNA - در سال 1986 توسط برنده جایزه والتر گیلبرت فرموله شد. با این حال، هنوز اثبات این موضوع دشوار است. این نظریه توسط حقایق آشکار پشتیبانی می شود - مولکول های tRNA قادر به ذخیره بلوک های اطلاعات هستند و به نوعی این اطلاعات را پیاده سازی می کنند، یعنی کار را انجام می دهند.
اما مخالفان این نظریه استدلال می کنند که یک دوره کوتاه از عمر یک ماده نمی تواند تضمین کند که tRNA حامل خوبی برای هر گونه اطلاعات بیولوژیکی است. این نوکلئوتیدها به سرعت تجزیه می شوند. طول عمر tRNA در سلول های انسانی از چند دقیقه تا چند ساعت متغیر است. برخی از انواع می توانند تا یک روز دوام داشته باشند. و اگر در مورد همان نوکلئوتیدها در باکتری ها صحبت کنیم، بازه زمانی بسیار کوتاهتر است - تا چند ساعت. علاوه بر این، ساختار و عملکرد tRNA برای این مولکول پیچیده تر از آن است که به عنصر اولیه زیست کره زمین تبدیل شود.
انتقال (محلول) RNA یک مولکول RNA با وزن مولکولی کم که عملکردهای آداپتوری برای انتقال ویژه اسیدهای آمینه به زنجیره های پلی پپتیدی در حال رشد در طول ترجمه انجام می دهد. tRNA ها دارای ساختار ثانویه مشخصی به شکل... ...
TRNA RNA محلول را ببینید. (منبع: "فرهنگ توضیحی انگلیسی-روسی اصطلاحات ژنتیکی". Arefiev V.A., Lisovenko L.A., Moscow: Publishing House VNIRO, 1995) ...
tRNA- انتقال اسید ریبونوکلئیک... فرهنگ اختصارات و اختصارات
ساختار انتقال RNA انتقال RNA، tRNA یک اسید ریبونوکلئیک است که وظیفه آن انتقال آمینو اسیدها به محل سنتز ... ویکی پدیا
فرهنگ لغت بزرگ پزشکی
اسید ریبونوکلئیک حمل و نقل را ببینید... دایره المعارف پزشکی
tRNA نوکلئوتیدیل ترانسفراز- آنزیمی که سه گانه CCA را به 3 انتهای tRNA نوع II متصل می کند (یعنی tRNA هایی که پیش سازهای آنها فاقد این سه گانه، برخی از tRNA های پروکاریوت ها و ظاهراً همه tRNA های یوکاریوت ها هستند). [Arefyev V.A.، Lisovenko L.A. فرهنگ لغت توضیحی انگلیسی به روسی... ... راهنمای مترجم فنی
ناحیه tRNA مانند- * قطعه مشابه tRNA، بخش انتهایی اسید نوکلئیک برخی از RNA های حاوی ویروس است که قادر به آمینواسیلاسیون و تعامل با برخی آنزیم های خاص است. برخلاف tRNA معمولی، tRNA حاوی... ژنتیک فرهنگ لغت دایره المعارفی
ناحیه tRNA مانند- بخش انتهایی اسید نوکلئیک برخی از ویروسهای حاوی RNA که قادر به آمینواسیلاسیون با یک اسید آمینه و تعامل با برخی آنزیمهای خاص است. برخلاف tRNA در tRNA p.u. هیچ پایگاه کمیاب یافت نشد... ... راهنمای مترجم فنی
TRNA نوکلئوتیدیل ترانسفراز tRNA نوکلئوتیدیل ترانسفراز. آنزیمی که سه گانه CCA را به 3 انتهای tRNA نوع II متصل می کند (یعنی tRNA هایی که پیش سازهای آنها فاقد این سه گانه هستند، برخی از tRNA های پروکاریوت ها و ظاهراً همه tRNA های یوکاریوت ها)... ... زیست شناسی مولکولی و ژنتیک. فرهنگ لغت.
کتاب ها
- فیزیک پارامترهای پنهان: , I. Bogdanov. این کار تضادهایی را که مانع از تشخیص فیزیک پارامترهای پنهان ایجاد شده بر اساس تئوری میدان های الکتریکی چرخش می شود، حذف می کند. مدرکی برای فرضیه های بور پیدا شد...
کتاب درسی. با وجود این واقعیت که tRNA بسیار کوچکتر است، داستان در مورد ساختار، ویژگی ها و عملکرد آن شایستگی یک فصل جداگانه را دارد.
بنابراین، tRNA یک «آداپتور» است که در یک انتها توالی سه حرفی کد ژنتیکی را تشخیص میدهد و آن را با تنها اسید آمینه مربوطه متصل به انتهای دیگر tRNA مطابقت میدهد. در انتهای RNA انتقالی که RNA پیام رسان را لمس می کند، 3 نوکلئوتید تشکیل می شود آنتی کدون. تنها در صورتی که آنتی کدون مکمل بخشی از mRNA باشد می تواند RNA انتقالی به آن متصل شود. اما حتی در این مورد، tRNA به تنهایی نمی تواند به mRNA بپیوندد، به کمک ریبوزوم، که محل برهم کنش آنها است، و همچنین به یک شرکت کننده فعال در ترجمه نیاز دارد. به عنوان مثال، این ریبوزوم است که بین آمینو اسیدهای وارد شده توسط tRNA پیوند ایجاد می کند و یک زنجیره پروتئینی را تشکیل می دهد.
ویژگی های ساختاری tRNA توسط کد ژنتیکی تعیین می شود، یعنی قوانین ساخت پروتئین با توجه به یک ژن، که RNA انتقالی خوانده می شود. این کد در هر موجودی که روی زمین زندگی می کند کار می کند: ایجاد یک ویروس در همان کدون های سه حرفی نوشته شده است که برای نوشتن "دستورالعمل های مونتاژ" دلفین ها استفاده می شود. به طور تجربی تأیید شده است که ژنهای یک موجود زنده، که در سلول موجود دیگر قرار میگیرد، کاملاً کپی شده و به پروتئینهایی ترجمه میشود که از ژنهای بازتولید شده در سلولهای میزبان قابل تشخیص نیستند. یکنواختی کد ژنتیکی اساس تولید انسولین و بسیاری دیگر از آنزیم های انسانی توسط کلنی های اشرشیاکلی اصلاح شده است که به عنوان دارو برای افرادی که بدن قادر به تولید آنها نیست یا به اندازه کافی آنها را تولید نمی کند، استفاده می شود. با وجود تفاوت های آشکار بین انسان و E. coli، پروتئین های انسانی به راحتی از طرح های او با استفاده از دستگاه تکثیر E. coli ایجاد می شود. جای تعجب نیست که RNA های انتقالی موجودات مختلف با هم تفاوت بسیار کمی دارند.

هر کدون در این لیست به جز سه کد کدون ها را متوقف کنیدبا دادن سیگنال در مورد تکمیل ترجمه، باید توسط RNA انتقالی شناسایی شود. تشخیص با اتصال یک آنتی کدون به RNA پیام رسان انجام می شود، که فقط می تواند به یک کدون از لیست متصل شود، بنابراین tRNA فقط می تواند یک کدون را تشخیص دهد. این بدان معناست که حداقل 61 نوع از این مولکول ها در سلول وجود دارد. در واقع، تعداد آنها حتی بیشتر است، زیرا در برخی شرایط، برای خواندن RNA پیام رسان، فقط داشتن آنتی کدون مورد نظر کافی نیست: شرایط دیگری نیز باید رعایت شود که مطابق با آنها یک tRNA خاص و اصلاح شده ایجاد می شود. .
در نگاه اول، چنین تنوعی از tRNA ها باید به طور قابل توجهی فرآیند ترجمه را پیچیده کند: از این گذشته، هر یک از این مولکول ها کدون RNA پیام رسان جایگزین شده توسط ریبوزوم را برای انطباق با آنتی کدون آن بررسی می کنند - به نظر می رسد که خیلی بی معنی است. کار مکانیکی، زمان و انرژی بسیار تلف شده است. اما در نتیجه تکامل، مکانیسم های سلولی نیز برای جلوگیری از این مشکل تکامل یافته است. به عنوان مثال، مقدار tRNA هر نوع در یک سلول مربوط به تعداد دفعات یافتن اسید آمینه حمل شده توسط آن نوع در پروتئین های ساخته شده است. آمینو اسیدهایی وجود دارند که به ندرت توسط سلول استفاده می شوند، و آمینو اسیدهایی هستند که اغلب استفاده می شوند، و اگر تعداد tRNA های حامل آنها یکسان بود، این امر به طور قابل توجهی ترکیب پروتئین ها را پیچیده می کند. بنابراین، تعداد کمی اسید آمینه «نادر» و tRNA مربوط به آنها در سلول وجود دارد، در حالی که آنهایی که اغلب وجود دارند در مقادیر زیادی تولید می شوند.

با چنین تنوعی از مولکولهای tRNA، همه آنها بسیار شبیه هستند، بنابراین هنگام بررسی ساختار و عملکرد آنها، ما عمدتاً ویژگیهای مشترک برای همه گونهها را مطالعه میکنیم. وقتی به نمودار سه بعدی tRNA نگاه می کنید، شبیه به هم آمیختگی متراکم از اتم ها به نظر می رسد. باور نکردنی به نظر می رسد که این مولکول پیچیده با تا کردن یک زنجیره طولانی از نوکلئوتیدها تولید می شود، اما دقیقاً به همین شکل است.
شما می توانید مراحل شکل گیری آن را ردیابی کنید، از همان ابتدا شروع کنید: جمع آوری یک توالی نوکلئوتیدی توسط RNA پلیمراز مطابق با ژن حاوی اطلاعات مربوط به این RNA انتقالی. ترتیب ظاهر شدن این نوکلئوتیدها یکی پس از دیگری و تعداد آنها نامیده می شود ساختار اولیه tRNA. به نظر می رسد که این ساختار اولیه tRNA است که در ژن خوانده شده توسط RNA پلیمراز کدگذاری می شود. به طور کلی، ساختار اولیه دنباله ای از مولکول های نسبتا ساده از یک نوع است که از آن یک مولکول پلیمری پیچیده تر و تا خورده تشکیل شده است. به عنوان مثال، ساختار اولیه یک مولکول پروتئین، توالی ساده اسیدهای آمینه تشکیل دهنده آن است.

هیچ زنجیره ای از نوکلئوتیدها نمی توانند در یک سلول در حالت باز شده باشند و به سادگی در یک خط کشیده شوند. در لبههای نوکلئوتیدها، بخشهای دارای بار مثبت و منفی زیادی وجود دارد که به راحتی با یکدیگر پیوند هیدروژنی تشکیل میدهند. نحوه تشکیل پیوندهای یکسان بین نوکلئوتیدهای دو مولکول DNA، وصل کردن آنها به یک مارپیچ دوگانه، در توضیح داده شده است، و برای جزئیات در مورد پیوندهای هیدروژنی می توانید به آن بروید. پیوندهای هیدروژنی نسبت به پیوندهای بین اتم ها در مولکول ها قوی تر هستند، اما برای پیچاندن رشته tRNA به روشی پیچیده و نگه داشتن آن در آن موقعیت کافی هستند. در ابتدا، این پیوندها فقط بین برخی از نوکلئوتیدها تشکیل می شوند و tRNA را به شکلی مانند برگ شبدر تا می کنند. نتیجه این تا شدن اولیه نامیده می شود ساختار ثانویه tRNA. نمودار سمت چپ نشان می دهد که فقط برخی از نوکلئوتیدها با پیوندهای هیدروژنی به هم متصل می شوند، در حالی که برخی دیگر جفت نشده باقی می مانند و حلقه ها و حلقه ها را تشکیل می دهند. تفاوت بین ساختار ثانویه گونه های مختلف tRNA به دلیل تفاوت در ساختار اولیه آنها است. این خود را در طول های مختلف "برگ شبدر" یا "ساقه" به دلیل طول های مختلف زنجیره اولیه نوکلئوتیدها نشان می دهد.
تفاوت دیگر در ساختار اولیه tRNA های مختلف این است که فقط در برخی موقعیت ها نوکلئوتیدهای یکسانی دارند (در نمودار بالا با حروف اول نام آنها مشخص شده است)، اما بیشتر نوکلئوتیدها در tRNA های مختلف با یکدیگر متفاوت هستند. نمودار بالا برای همه tRNA ها مشترک است، بنابراین نوکلئوتیدهای مختلف با اعداد مشخص می شوند.
بخش های عملکردی اصلی tRNA عبارتند از:
=) آنتی کدون، یعنی یک توالی نوکلئوتیدی مکمل تنها کدون RNA پیام رسان، واقع در سنجاق سر آنتی کدون
=) پایان پذیرنده، که می توان اسید آمینه را به آن متصل کرد. در طرف مقابل سنجاق سر آنتی کدون قرار دارد.
در واقع، هیچ tRNA واحدی مانند آن در نمودار ساختار ثانویه به نظر نمی رسد، زیرا فقط برخی از نوکلئوتیدها به هم پیوستند تا آن را تشکیل دهند، در حالی که بقیه بدون جفت باقی ماندند. به دلیل تشکیل پیوندهای هیدروژنی بین نوکلئوتیدها از قسمتهای مختلف برگ شبدر، بیشتر به شکل پیچیدهتری جمع میشود. ساختار سومبه شکل حرف L. با تطبیق رنگ ها در نمودارهای زیر می توانید دقیقاً بفهمید که چگونه قسمت های مختلف سازه ثانویه برای تشکیل ساختار سوم خم می شوند. سنجاق سر آنتی کدون که به رنگ آبی و خاکستری نشان داده شده است، در پایین باقی می ماند (لازم به یادآوری است که این "پایین" دلخواه است: به راحتی می توان tRNA را در این جهت فضایی در نمودارهای ترجمه پروتئین نشان داد)، و انتهای پذیرنده (زرد) به پهلو خم شده است

زمانی که tRNA برای اتصال یک اسید آمینه آماده می شود، اینگونه به نظر می رسد. tRNA به خودی خود قادر به ترکیب با یک اسید آمینه نیست و این امر مستلزم مشارکت یک آنزیم خاص است: آمینواسیل-tRNA سنتتازها. تعداد انواع سنتتازها در یک سلول با تعداد انواع tRNA مطابقت دارد.
یکنواختی شکل همه انواع tRNA ضروری است تا ریبوزوم بتواند هر یک از آنها را تشخیص دهد، اتصال آنها به mRNA را تسهیل کند و آنها را درون خود از یک مکان به مکان دیگر منتقل کند. اگر انواع مختلف tRNA به طور قابل توجهی با یکدیگر متفاوت بودند، این کار کار ریبوزوم را به شدت دشوار می کرد و به طور قابل توجهی سرعت سنتز پروتئین را کاهش می داد. بنابراین هدف انتخاب طبیعی شبیه سازی tRNA ها به یکدیگر است. اما در عین حال، عامل دیگری وجود دارد که وجود تفاوت های محسوس بین انواع مختلف tRNA را می طلبد: از این گذشته، لازم است هر نوع را بشناسیم و تنها اسید آمینه مربوط به آن را به آن وصل کنیم. بدیهی است که این تفاوت ها باید قابل توجه باشد، اما نه خیلی قابل توجه، بنابراین کار شناسایی انواع tRNA به یک فرآیند جواهر تبدیل می شود. و این دقیقاً همان کاری است که آمینواسیل-tRNA سنتتازها انجام می دهند: هر یک از آنها می توانند تنها با یکی از 20 اسید آمینه تماس بگیرند و آن را دقیقاً به آن دسته از انواع tRNA که با این اسید آمینه مطابقت دارند متصل کنند. از جدول با کد ژنتیکی مشخص است که هر اسید آمینه توسط چندین توالی نوکلئوتیدی کدگذاری می شود، بنابراین، برای مثال، هر چهار tRNA با آنتی کدون های CGA، CGG، CGU و CGC توسط همان سنتتاز شناسایی می شوند که آلانین را به آن متصل می کند. آنها را چنین tRNA هایی که توسط یک سنتتاز پردازش می شوند نامیده می شوند مربوط.
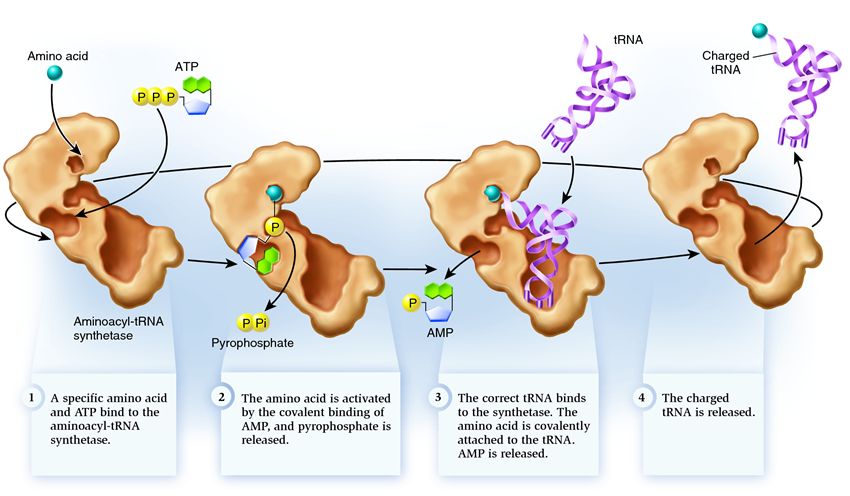
سنتتاز به گروهی از آنزیم ها تعلق دارد که وظیفه آنها اتصال به مولکول های موجود جداگانه و ترکیب آنها در یک آن است:
1 . سنتتاز یک آمینو اسید و یک مولکول ATP را به هم متصل می کند. دو گروه فسفات از ATP جدا می شوند و انرژی مورد نیاز برای مراحل بعدی را آزاد می کنند. آدنوزین مونوفسفات (AMP) باقی مانده از مولکول تخریب شده به اسید آمینه می چسبد و آن را برای اتصال با سنجاق سر پذیرنده آماده می کند.
2 . سنتتاز یکی از tRNA های مربوط به این اسید آمینه را به خود متصل می کند.

در این مرحله مطابقت RNA سنتتاز انتقالی بررسی می شود. چندین روش تشخیص وجود دارد و هر سنتتاز ترکیبی منحصر به فرد از آنها دارد. حداقل یک نوکلئوتید از آنتی کدون در تعامل سنتتاز و tRNA نقش دارد. سنجاق سر پذیرنده نیز نیاز به بررسی دارد: وجود نوکلئوتیدهای خاص روی آن مشخص می شود که در tRNA های مرتبط با اسید آمینه مورد نظر مشترک هستند. نوکلئوتیدهای سایر بخشهای tRNA نیز میتوانند با اتصال به مکانهای خاص در سنتتاز در تطابق شرکت کنند. یک tRNA نادرست ممکن است در برخی پارامترها با نمونه مورد نظر مطابقت داشته باشد، اما به دلیل تطابق ناقص، به آرامی و شل به سنتتاز متصل می شود و به راحتی می افتد. و tRNA صحیح به سرعت و محکم به سنتتاز می چسبد، در نتیجه ساختار سنتتاز تغییر می کند و فرآیند را شروع می کند. آمینواسیلاسیون یعنی افزودن یک اسید آمینه به tRNA.

3 . آمینواسیلاسیون شامل جایگزینی یک مولکول AMP متصل به یک اسید آمینه با یک مولکول tRNA است. پس از این جایگزینی، AMP سنتتاز را ترک می کند و tRNA برای یک بررسی نهایی اسید آمینه عقب نگه داشته می شود. اگر اسید آمینه متصل نادرست تشخیص داده شود، از tRNA جدا می شود و جای اسید آمینه در سنتتاز خالی می ماند و مولکول دیگری می تواند به آنجا بپیوندد. آمینو اسید جدید مراحل ترکیب با ATP و tRNA را طی خواهد کرد و همچنین مورد آزمایش قرار خواهد گرفت. اگر هیچ اشتباهی مرتکب نشده باشد، tRNA شارژ شده با اسید آمینه آزاد می شود: آماده است تا نقش خود را در ترجمه پروتئین ایفا کند. و سنتتاز آماده اتصال اسیدهای آمینه و tRNA های جدید است و چرخه دوباره شروع می شود.
خیلی به عملکرد صحیح آمینواسیل-tRNA سنتتاز بستگی دارد: اگر در این مرحله شکستی رخ دهد، اسید آمینه اشتباهی به tRNA متصل می شود. و در پروتئینی که روی ریبوزوم رشد می کند ساخته می شود، زیرا tRNA و ریبوزوم وظیفه بررسی مطابقت کدون و اسید آمینه را ندارند. پیامدهای یک خطا میتواند جزئی یا فاجعهبار باشد و در جریان انتخاب طبیعی، موجوداتی با آنزیمهایی که عملکرد چنین بررسیهایی را ندارند، جایگزین آنزیمهای سازگارتر شدند که گزینههای متفاوتی برای برقراری ارتباط بین اسید آمینه و tRNA داشتند. . بنابراین، در سلول های مدرن، سنتتاز به طور متوسط در یک مورد از 50 هزار مورد با اسید آمینه اشتباه ترکیب می شود، و با tRNA اشتباه تنها یک بار در 100 هزار اتصال.

برخی از اسیدهای آمینه فقط چند اتم با یکدیگر تفاوت دارند. اگر به نمودارهای آنها نگاه کنید، مشخص می شود که احتمال اشتباه آرژنین با آلانین بسیار کمتر از اشتباه گرفتن ایزولوسین با لوسین یا والین است. بنابراین، هر سنتتازی که به یکی از اسیدهای آمینه مشابه یکدیگر متصل می شود، مکانیسم های تأیید اضافی دارد. در اینجا نمونه ای از چنین سازگاری در سنتتاز ایزولوسین-tRNA آورده شده است:

هر سنتتاز دارای مرکز مصنوعی، که در آن یک اسید آمینه به tRNA اضافه می شود. سنجاق موی گیرنده tRNA که توسط سنتتاز گرفته میشود، مانند اسید آمینه، آماده واکنش با آن است. کار برخی از سنتتازها بلافاصله پس از ترکیب اسید آمینه و tRNA به پایان می رسد. اما Ile-tRNA سنتتاز به دلیل وجود اسیدهای آمینه دیگر مشابه ایزولوسین، احتمال خطای بیشتری دارد. بنابراین او نیز دارد کانون اصلاح و تربیت: از نام آن مشخص است که چه نقشی در فرآیند اتصال tRNA و اسید آمینه ایفا می کند. شکل سمت راست نشان می دهد که موقعیت انتهای سنجاق سر tRNA گیرنده در مرکز مصنوعی سنتتاز Ile-tRNA به این سنجاق خمیدگی غیرطبیعی می دهد. با این حال، سنتتاز tRNA را در این موقعیت نگه می دارد تا زمانی که یک اسید آمینه به آن اضافه شود. پس از این اتصال، نیاز به قرار گرفتن سنجاق سر پذیرنده در مرکز مصنوعی تمام میشود و tRNA صاف میشود و انتهای آن با اسید آمینه متصل به آن در مرکز تصحیح به پایان میرسد.

البته مرکز مصنوعی در غربالگری آمینو اسیدهایی که برای سنتتاز مناسب نیستند نیز نقش دارد. برای ورود به آن، یک مولکول باید تعدادی از شرایط، از جمله داشتن اندازه مناسب را داشته باشد. اگرچه لوسین و ایزولوسین دارای تعداد یکسانی اتم هستند، به دلیل تفاوت در ساختار فضایی، لوسین بزرگتر است. بنابراین، نمی تواند به مرکز مصنوعی، که اندازه آن مطابق با ایزولوسین فشرده تر است، نفوذ کند و به سادگی از سنتتاز Ile-tRNA منعکس می شود.
اما والین که کوچکترین این سه مولکول با ساختار اتمی مشابه است، به راحتی جای ایزولوسین را در مرکز سنتزی می گیرد و سنتتاز آن را به tRNA متصل می کند. اینجاست که مرکز تصحیح سنتتاز وارد عمل می شود. اگر گیره موی گیرنده صاف کننده به درستی شارژ شده باشد و ایزولوسین را حمل کند، نمی تواند در مرکز اصلاح فشار بیاورد: برای این مولکول بسیار کوچک است. بنابراین، هیچ چیز دیگر tRNA صاف شده را نگه نمی دارد و از سنتتاز جدا می شود. اما اگر والین به tRNA متصل شود، به مرکز تصحیح می لغزد و در نتیجه tRNA متصل به آن در سنتتاز نگه میدارد. چنین حضور بیش از حد طولانی tRNA در داخل یک سیگنال خطا برای سنتتاز است که پیکربندی فضایی آن را تغییر میدهد. در نتیجه:
=) والین از tRNA جدا شده و از سنتتاز خارج می شود
=) سنجاق موی پذیرنده به مرکز مصنوعی باز می گردد و در انتظار اتصال به اسید آمینه است
=) سنتتاز به اسید آمینه جدید متصل می شود، tRNA را با آن "شارژ" می کند و دوباره بررسی می کند که آیا ایزولوسین برای این کار استفاده شده است یا خیر.
یک مکانیسم شناسایی دوگانه مشابه توسط سایر سنتتازها استفاده می شود.
آمینواسیل-tRNA سنتتاز (ARCase) یک آنزیم سنتتاز است که تشکیل aminoacyl-tRNA را در واکنش استری شدن یک اسید آمینه خاص با مولکول tRNA مربوطه آن کاتالیز می کند. هر اسید آمینه آمینواسیل-tRNA سنتتاز خاص خود را دارد. ARSaseها انطباق با سه گانه نوکلئوتیدی کد ژنتیکی (آنتی کدون tRNA) اسیدهای آمینه ساخته شده در پروتئین را تضمین می کنند و بنابراین از صحت خواندن بعدی اطلاعات ژنتیکی از mRNA در طول سنتز پروتئین روی ریبوزوم ها اطمینان حاصل می کنند. اکثر APCase ها از 1، 2 یا 4 زنجیره پلی پپتیدی یکسان تشکیل شده اند. وزن مولکولی زنجیره های پلی پپتیدی 30-140 هزار است. 3 قطعه وجود دارد. ناحيه اول ويژگي آن براي همه آنزيم ها يكسان است. ناحيه دوم داراي ويژگي دقيقي است كه در اينجا AK متصل مي شود، به همين دليل است كه به عنوان مثال، ARSase ناميده مي شود. ناحیه سوم نیز یک ناحیه کاملاً خاص است و فقط می تواند به یک tRNA خاص متصل شود. بنابراین، آنزیم برای شناسایی اسید آمینه و tRNA ضروری است.
ویژگی واکنش های کاتالیز شده توسط APCase ها بسیار بالا است که دقت سنتز پروتئین در یک سلول زنده را تعیین می کند. اگر A. آمینواسیلاسیون اشتباه یک tRNA را با یک اسید آمینه مشابه در ساختار انجام دهد، اصلاح از طریق هیدرولیز AA-tRNA های اشتباه که توسط همان APCase به AA و tRNA کاتالیز می شوند، رخ می دهد. سیتوپلاسم شامل مجموعه ای کامل از کلروپلاست ها است و میتوکندری ها APCase های خاص خود را دارند.
انتقال RNA ساختار، توابع. ساختار ریبوزوم ها
همه tRNA ها هم در ساختار اولیه خود و هم در نحوه تا شدن زنجیره پلی نوکلئوتیدی به یک ساختار ثانویه به دلیل برهمکنش بین پایه های باقی مانده های نوکلئوتیدی دارای ویژگی های مشترک هستند.
ساختار اولیه tRNA
tRNA ها مولکول های نسبتا کوچکی هستند، طول زنجیره های آنها از 74 تا 95 باقی مانده نوکلئوتیدی متغیر است. همه tRNA ها انتهای 3 اینچی یکسانی دارند که از دو باقی مانده سیتوزین و یک باقی مانده آدنوزین (CCA end) ساخته شده اند. این آدنوزین انتهایی 3 اینچی است که در طول تشکیل aminoacyl-tRNA به باقی مانده اسید آمینه متصل می شود. انتهای CCA توسط یک آنزیم خاص به بسیاری از tRNA ها متصل می شود. سه گانه نوکلئوتیدی مکمل کدون یک اسید آمینه (آنتیکودون) تقریباً در وسط زنجیره tRNA قرار دارد. در موقعیتهای خاصی در توالی، تقریباً همه انواع tRNA حاوی باقیماندههای نوکلئوتیدی (حفظشده) یکسانی هستند. برخی از موقعیت ها ممکن است فقط حاوی بازهای پورین یا فقط پیریمیدین باشند (به آنها باقیمانده های نیمه محافظه کار گفته می شود).
همه مولکولهای tRNA با حضور تعداد زیادی (تا 25 درصد از تمام باقیماندهها) از نوکلئوزیدهای اصلاحشده مختلف مشخص میشوند که اغلب آنها را جزئی مینامند. آنها در مکان های مختلفی در مولکول ها، در بسیاری از موارد به خوبی تعریف شده، در نتیجه اصلاح باقی مانده های نوکلئوزیدی معمولی توسط آنزیم های خاص تشکیل می شوند.
ساختار ثانویه tRNA
تا شدن زنجیره به یک ساختار ثانویه به دلیل مکمل بودن متقابل بخش های زنجیره رخ می دهد. این سه تکه زنجیره وقتی روی خود تا میشوند مکمل یکدیگر میشوند و ساختارهایی شبیه سنجاق سر را تشکیل میدهند. علاوه بر این، انتهای 5 اینچی مکمل ناحیه نزدیک به انتهای 3 اینچی زنجیره است، با آرایش ضد موازی آنها. آنها به اصطلاح ساقه پذیرنده را تشکیل می دهند. نتیجه ساختاری است که با وجود چهار ساقه و سه حلقه مشخص می شود که به آن "برگ شبدر" می گویند. ساقه و حلقه یک شاخه تشکیل می دهند. در پایین شاخه آنتی کدون قرار دارد که شامل یک سه گانه آنتی کدون به عنوان بخشی از حلقه آن است. در سمت چپ و راست این شاخههای D و T قرار دارند که به ترتیب به دلیل وجود نوکلئوزیدهای غیرمعمول حفظ شده دی هیدرووریدین (D) و تیمیدین (T) در حلقههایشان نامگذاری شدهاند. توالی های نوکلئوتیدی همه tRNA های مورد مطالعه را می توان در ساختارهای مشابه تا کرد. علاوه بر سه حلقه برگ شبدر، tRNA یک حلقه اضافی یا متغیر (حلقه V) نیز دارد. اندازه آن در میان tRNA های مختلف به شدت متفاوت است، از 4 تا 21 نوکلئوتید، و طبق آخرین داده ها، تا 24 نوکلئوتید متغیر است.
ساختار فضایی (ثالثیه) tRNA
در اثر متقابل عناصر ساختار ثانویه، ساختار ثالثی به وجود می آید که به دلیل شباهت با حرف لاتین L به آن شکل L می گویند (شکل 2 و 3). با انباشته شدن پایه، ساقه گیرنده و ساقه T برگ شبدر یک مارپیچ مضاعف پیوسته و دو ساقه دیگر، آنتی کدون و D، یک مارپیچ مضاعف ممتد دیگر را تشکیل می دهند. در این حالت، حلقههای D و T به هم نزدیکتر میشوند و با تشکیل جفتهای پایه اضافی، اغلب غیرمعمول، به هم متصل میشوند. باقی مانده های محافظه کار یا نیمه محافظه کار، به عنوان یک قاعده، در تشکیل این جفت ها شرکت می کنند. فعل و انفعالات ثالثی مشابه برخی از بخش های دیگر ساختار L را کنار هم نگه می دارد
هدف اصلی انتقال RNA (tRNA) رساندن بقایای اسید آمینه فعال به ریبوزوم و اطمینان از گنجاندن آنها در زنجیره پروتئین سنتز شده مطابق با برنامه نوشته شده توسط کد ژنتیکی در ماتریس یا اطلاعات، RNA (mRNA) است.
ساختار ریبوزوم ها
ریبوزوم ها تشکیلات ریبونوکلئوپروتئینی هستند - نوعی "کارخانه" که در آن اسیدهای آمینه به پروتئین ها مونتاژ می شوند. ریبوزوم های یوکاریوتی دارای ثابت ته نشینی 80S هستند و از 40S (کوچک) و 60S (بزرگ) تشکیل شده اند. هر زیر واحد شامل rRNA و پروتئین است.
پروتئین ها بخشی از زیر واحدهای ریبوزومی در یک نسخه هستند و عملکرد ساختاری را انجام می دهند و برهمکنش بین mRNA و tRNA مرتبط با اسید آمینه یا پپتید را فراهم می کنند.
در حضور mRNA، زیرواحدهای 40S و 60S با هم ترکیب میشوند و یک ریبوزوم کامل را تشکیل میدهند که وزن آن تقریباً 650 برابر جرم یک مولکول هموگلوبین است.
ظاهراً rRNA خصوصیات اساسی ساختاری و عملکردی ریبوزوم ها را تعیین می کند، به ویژه، یکپارچگی زیر واحدهای ریبوزومی را تضمین می کند، شکل آنها و تعدادی از ویژگی های ساختاری را تعیین می کند.
اتحاد زیر واحدهای بزرگ و کوچک در حضور RNA پیام رسان (mRNA) رخ می دهد. یک مولکول mRNA معمولا چندین ریبوزوم را مانند رشته ای از مهره ها به هم متصل می کند. به این ساختار پلی زومی می گویند. پلی زوم ها آزادانه در ماده اصلی سیتوپلاسم قرار دارند یا به غشاهای شبکه سیتوپلاسمی خشن متصل می شوند. در هر دو مورد، آنها به عنوان محل سنتز پروتئین فعال عمل می کنند.
مانند شبکه آندوپلاسمی، ریبوزوم ها تنها با استفاده از میکروسکوپ الکترونی کشف شدند. ریبوزوم ها کوچکترین اندامک های سلولی هستند.
ریبوزوم دارای 2 مرکز برای اتصال مولکول های tRNA است: مراکز آمینواسیل (A) و پپتیدیل (P) که هر دو زیر واحد در تشکیل آنها شرکت می کنند. مراکز A و P با هم شامل ناحیه ای از mRNA برابر با 2 کدون هستند. در حین ترجمه، مرکز A به aa-tRNA متصل می شود که ساختار آن توسط کدون واقع در ناحیه این مرکز مشخص می شود. ساختار این کدون ماهیت اسید آمینه ای را رمزگذاری می کند که در زنجیره پلی پپتیدی در حال رشد گنجانده می شود. مرکز P توسط peptidyl-tRNA اشغال شده است. tRNA متصل به یک زنجیره پپتیدی که قبلاً سنتز شده است.
در یوکاریوت ها، دو نوع ریبوزوم وجود دارد: "آزاد" که در سیتوپلاسم سلول ها یافت می شود و آنهایی که با شبکه آندوپلاسمی (ER) مرتبط هستند. ریبوزوم های مرتبط با ER مسئول سنتز پروتئین های "برای صادرات" هستند که در پلاسمای خون آزاد می شوند و در تجدید پروتئین های ER، غشای دستگاه گلژی، میتوکندری یا لیزوزوم ها نقش دارند.
سنتز یک مولکول پلی پپتیدی شروع و طویل شدن.
سنتز پروتئین یک فرآیند حلقوی، چند مرحله ای و وابسته به انرژی است که در آن اسیدهای آمینه آزاد به یک توالی تعیین شده ژنتیکی پلیمریزه می شوند تا پلی پپتیدها را تشکیل دهند.
مرحله دوم سنتز پروتئین ماتریکس، ترجمه واقعی که در ریبوزوم اتفاق می افتد، به طور معمول به سه مرحله تقسیم می شود: شروع، افزایش طول و پایان.
شروع.
دنباله ای از DNA رونویسی شده به یک mRNA واحد، که با جستجو در انتهای 5 شروع می شود و با پایان دهنده در انتهای 3 پایان می یابد، یک واحد رونویسی است و با مفهوم "ژن" مطابقت دارد. کنترل بیان ژن را می توان در مرحله شروع ترجمه انجام داد. در این مرحله، RNA پلیمراز پروموتر را می شناسد - قطعه ای به طول 41-44 جفت باز. رونویسی در جهت 5`-3` یا از چپ به راست انجام می شود. توالیهایی که در سمت راست نوکلئوتید آغازین قرار دارند، که سنتز tRNA از آن آغاز میشود، با اعداد با علامت + (+1،+2..) و آنهایی که در سمت چپ با علامت – (-1،-2) قرار دارند مشخص میشوند. بنابراین، ناحیه ای از DNA که DNA پلیمراز به آن متصل می شود، منطقه ای با مختصات تقریباً 20- تا 20+ را اشغال می کند. همه پروموترها حاوی توالی های نوکلئوتیدی یکسانی هستند که به آنها حفظ شده می گویند. چنین توالی هایی به عنوان سیگنال های شناسایی شده توسط RNA پلیمرازها عمل می کنند. نقطه شروع معمولاً پورین است. بلافاصله در سمت چپ این 6-9 جفت باز است که به دنباله (یا جعبه) Pribnow معروف است: TATAAT. می تواند تا حدودی متفاوت باشد، اما دو پایه اول در بیشتر پروموترها قرار می گیرند. فرض بر این است که از آنجایی که توسط ناحیه ای غنی از جفت های AT تشکیل شده است که توسط دو پیوند هیدروژنی به هم متصل شده اند، DNA در این مکان راحت تر به رشته های جداگانه جدا می شود. این شرایط برای عملکرد RNA پلیمراز ایجاد می کند. علاوه بر این، جعبه Pribnow برای جهتیابی به گونهای ضروری است که سنتز mRNA از چپ به راست، یعنی از 5`-3` انجام شود. مرکز جعبه پریبنو در نوکلئوتید -10 است. دنباله ای از ترکیب مشابه در ناحیه دیگری به مرکزیت موقعیت 35 واقع شده است. این ناحیه، متشکل از 9 جفت باز، به دنباله 35 یا ناحیه تشخیص تعیین می شود. این محلی است که فاکتور به آن متصل می شود، در نتیجه بازدهی را تعیین می کند که RNA پلیمراز نمی تواند بدون پروتئین های خاص رونویسی را آغاز کند. یکی از آنها فاکتور CAP یا CRP است.
در یوکاریوت ها، پروموترهایی که با RNA پلیمراز II تعامل دارند با جزئیات بیشتری مورد مطالعه قرار گرفته اند. آنها شامل سه بخش همولوگ در مناطق با مختصات در نقاط -25، -27 و همچنین در نقطه شروع هستند. پایه های آغازین آدنین هستند که در دو طرف پیریمیدین ها قرار دارند. در فاصله 19-25 جفت باز. 7 جفت باز در سمت چپ سایت قرار دارد. TATAA، معروف به دنباله TATA یا جعبه Hogness، اغلب توسط مناطق غنی از جفت GC احاطه شده است. حتی بیشتر در سمت چپ، در موقعیت های 70- تا 80-، دنباله GTZ یا CAATCT قرار دارد که جعبه CAAT نامیده می شود. فرض بر این است که توالی TATA انتخاب نوکلئوتید شروع را کنترل می کند و CAAT اتصال اولیه RNA پلیمراز به الگوی DNA را کنترل می کند.
ازدیاد طول. مرحله ازدیاد طول mRNA مشابه ازدیاد طول DNA است. به عنوان پیش ساز به ریبونوکلئوتید تری فسفات نیاز دارد. مرحله طویل شدن رونویسی، یعنی رشد زنجیره mRNA، با چسباندن ریبونوکلئوتید مونوفسفات ها به انتهای 3' زنجیره با آزاد شدن پیروفسفات رخ می دهد. کپی برداری در یوکاریوت ها معمولاً در بخش محدودی از DNA (ژن) اتفاق می افتد، اگرچه در پروکاریوت ها، در برخی موارد، رونویسی می تواند به طور متوالی از طریق چندین ژن مرتبط که یک اپرون واحد و یک پروموتر مشترک را تشکیل می دهند، رخ دهد. در این حالت mRNA پلی سیسترونیک تشکیل می شود.
تنظیم فعالیت ژن با استفاده از مثال اپرون لاکتوز.
اپرون لاکتوز یک اپرون پلی سیسترونیک از باکتری است که ژن های متابولیسم لاکتوز را کد می کند.
تنظیم بیان ژن های متابولیسم لاکتوز در اشریشیا کلی برای اولین بار در سال 1961 توسط دانشمندان F. Jacob و J. Monod توصیف شد. یک سلول باکتری تنها زمانی آنزیم های دخیل در متابولیسم لاکتوز را سنتز می کند که لاکتوز در محیط وجود داشته باشد و سلول فاقد گلوکز باشد.
اپرون لاکتوز از سه ژن ساختاری، یک پروموتر، یک اپراتور و یک پایان دهنده تشکیل شده است. فرض بر این است که اپرون همچنین شامل یک ژن تنظیم کننده است که یک پروتئین سرکوب کننده را کد می کند.
ژن های ساختاری اپرون لاکتوز - lacZ، lacY و lacA:
lacZ آنزیم β-گالاکتوزیداز را رمزگذاری می کند که دی ساکارید لاکتوز را به گلوکز و گالاکتوز تجزیه می کند.
lacY بتا-گالاکتوزید پرماز را کد می کند، یک پروتئین ناقل غشایی که لاکتوز را به داخل سلول منتقل می کند.
lacA بتا-گالاکتوزید ترانس استیلاز را کد می کند، آنزیمی که یک گروه استیل را از استیل-CoA به β-گالاکتوزیدها منتقل می کند.
در ابتدای هر اپرون یک ژن خاص وجود دارد - ژن اپراتور. یک m-RNA معمولاً روی ژنهای ساختاری یک اپرون تشکیل میشود و این ژنها میتوانند به طور همزمان فعال یا غیرفعال باشند. به عنوان یک قاعده، ژن های ساختاری در یک اپرون در حالت سرکوب هستند.
یک پروموتر بخشی از DNA است که توسط آنزیم RNA پلیمراز شناسایی می شود، که سنتز m-RNA را در اپرون تضمین می کند، قبل از بخشی از DNA که پروتئین Sar، یک پروتئین فعال کننده، به آن متصل است. این دو بخش از DNA از 85 جفت نوکلئوتید تشکیل شده است. پس از پروموتر، اپرون حاوی یک ژن اپراتور است که از 21 جفت نوکلئوتیدی تشکیل شده است. فاصلهگذارها بخشهای غیر اطلاعاتی یک مولکول DNA با طولهای مختلف (گاهی تا 20000 جفت باز) هستند که ظاهراً در تنظیم فرآیند رونویسی یک ژن همسایه شرکت میکنند.
اپرون با پایان دهنده به پایان می رسد - بخش کوچکی از DNA که به عنوان یک سیگنال توقف برای سنتز m-RNA در این اپرون عمل می کند.
ژنهای گیرنده بهعنوان محل اتصال پروتئینهای مختلف عمل میکنند که عملکرد ژنهای ساختاری را تنظیم میکنند. اگر لاکتوز با نفوذ به داخل سلول (در این مورد به آن القا کننده گفته می شود)، پروتئین های کدگذاری شده توسط ژن تنظیم کننده را مسدود کند، آنگاه توانایی اتصال به ژن اپراتور را از دست می دهند. ژن اپراتور به حالت فعال می رود و ژن های ساختاری را روشن می کند.
RNA پلیمراز با کمک پروتئین Cap (پروتئین فعال کننده)، به پروموتر متصل می شود و با حرکت در امتداد اپرون، pro-m-RNA را سنتز می کند. در طول رونویسی، m-RNA اطلاعات ژنتیکی همه ژنهای ساختاری را در یک اپرون میخواند. در طول ترجمه بر روی ریبوزوم، چندین زنجیره پلی پپتیدی مختلف مطابق با کدون های موجود در m-RNA - توالی های نوکلئوتیدی سنتز می شوند که شروع و پایان ترجمه هر زنجیره را تضمین می کند. نوع تنظیم عملکرد ژن که با استفاده از مثال اپرون لاکتوز در نظر گرفته می شود، القای منفی سنتز پروتئین نامیده می شود.
تنظیم فعالیت ژن با استفاده از مثال اپرون تریپتوفان.
نوع دیگری از تنظیم ژن، سرکوب منفی است که در E.coU با استفاده از مثال اپرونی که سنتز اسید آمینه تریپتوفون را کنترل می کند مورد مطالعه قرار گرفت. این اپرون از 6700 جفت نوکلئوتیدی تشکیل شده و شامل 5 ژن ساختاری، یک ژن اپراتور و دو پروموتر می باشد. ژن تنظیم کننده سنتز ثابت یک پروتئین تنظیمی را تضمین می کند که بر عملکرد اپرون trp تأثیر نمی گذارد. هنگامی که مقدار تریپتوفان در سلول وجود دارد، دومی به پروتئین تنظیم کننده متصل می شود و آن را به گونه ای تغییر می دهد که به اپرون متصل می شود و سنتز m-RNA مربوطه را سرکوب می کند.
کنترل منفی و مثبت فعالیت ژنتیکی.
به اصطلاح القای مثبت نیز شناخته شده است، زمانی که محصول پروتئینی ژن تنظیم کننده، عملکرد اپرون را فعال می کند، یعنی. یک سرکوبگر نیست، بلکه یک فعال کننده است، این تقسیم بندی مشروط است و ساختار بخش پذیرنده اپرون و عملکرد تنظیم کننده ژن در پروکاریوت ها بسیار متنوع است.
تعداد ژن های ساختاری در یک اپرون در پروکاریوت ها از یک تا دوازده متغیر است. یک اپرون ممکن است یک یا دو پروموتر و پایان دهنده داشته باشد. همه ژنهای ساختاری که در یک اپرون قرار دارند، معمولاً سیستمی از آنزیمها را کنترل میکنند که یک زنجیره از واکنشهای بیوشیمیایی را فراهم میکنند. شکی نیست که در سلول سیستم هایی وجود دارد که تنظیم چند اپرون را هماهنگ می کند.
پروتئین هایی که سنتز m-RNA را فعال می کنند به بخش اول گیرنده ژن - اپراتور و به انتهای آن - پروتئین های سرکوب کننده متصل می شوند که سنتز m-RNA را سرکوب می کنند. یک ژن منفرد توسط یکی از چندین پروتئین تنظیم می شود که هر کدام به یک محل گیرنده مربوطه متصل می شوند. ژن های مختلف می توانند تنظیم کننده های مشترک و مناطق عملگر یکسان داشته باشند. تنظیم کننده های ژن به طور همزمان عمل نمی کنند. ابتدا یکی بلافاصله یک گروه از ژن ها را روشن می کند، سپس بعد از مدتی دیگری گروه دیگری را روشن می کند، یعنی. تنظیم فعالیت ژن در "آبشار" رخ می دهد، و پروتئین سنتز شده در یک مرحله می تواند تنظیم کننده سنتز پروتئین در مرحله بعدی باشد.
ساختار کروموزوم ها. کاریوتایپ. ایدیوگرام. مدل های ساختار کروموزوم
کروموزوم های یوکاریوتی ساختار پیچیده ای دارند. اساس کروموزوم یک ماکرومولکول خطی (نه در حلقه بسته) از اسید دئوکسی ریبونوکلئیک (DNA) با طول قابل توجهی است (به عنوان مثال، در مولکول های DNA کروموزوم های انسانی از 50 تا 245 میلیون جفت باز نیتروژنی وجود دارد). در صورت کشیده شدن، طول کروموزوم انسان می تواند به 5 سانتی متر برسد، علاوه بر آن، کروموزوم شامل پنج پروتئین تخصصی - H1، H2A، H2B، H3 و H4 (به اصطلاح هیستون ها) و تعدادی پروتئین غیر هیستونی است. . توالی اسید آمینه هیستون ها به شدت حفظ شده است و عملاً در متنوع ترین گروه های موجودات متفاوت است. در اینترفاز کروماتین متراکم نمی شود، اما حتی در این زمان رشته های آن مجموعه ای از DNA و پروتئین است. کروماتین یک دئوکسی ریبونوکلئوپروتئین است که در زیر میکروسکوپ نوری به شکل رشته ها و دانه های نازک قابل مشاهده است. ماکرومولکول DNA به دور اکتومرها (ساختارهای متشکل از هشت گلبول پروتئینی) پروتئین های هیستونی H2A، H2B، H3 و H4 می پیچد و ساختارهایی به نام نوکلئوزوم را تشکیل می دهد.
به طور کلی، کل ساختار تا حدودی یادآور مهره ها است. دنباله ای از چنین نوکلئوزومی هایی که توسط پروتئین H1 متصل می شوند، نوکلئوفیلامنت یا رشته نوکلئوزومی با قطر حدود 10 نانومتر نامیده می شود.
کروموزوم متراکم شکل X (اغلب با بازوهای نابرابر) دارد زیرا دو کروماتید حاصل از همانندسازی هنوز در سانترومر به هم متصل هستند. هر سلول بدن انسان دقیقاً حاوی 46 کروموزوم است. کروموزوم ها همیشه جفت هستند. همیشه 2 کروموزوم از هر نوع در یک سلول وجود دارد که از نظر طول، شکل و وجود ضخامت یا انقباض با یکدیگر متفاوت هستند.
سانترومر یک ناحیه سازمان یافته خاص از کروموزوم است که برای هر دو کروماتید خواهر مشترک است. سانترومر جسم کروموزوم را به دو بازو تقسیم می کند. بسته به محل انقباض اولیه، انواع کروموزوم های زیر متمایز می شوند: بازوهای مساوی (متاسانتریک)، زمانی که سانترومر در وسط قرار دارد و طول بازوها تقریباً برابر است. بازوهای نابرابر (submetacentric)، هنگامی که سانترومر از وسط کروموزوم جابجا می شود و طول بازوها نابرابر است. میله ای شکل (اکروسنتریک)، زمانی که سانترومر به یک انتهای کروموزوم منتقل می شود و یک بازو بسیار کوتاه است. برخی از کروموزوم ها ممکن است دارای انقباضات ثانویه باشند که ناحیه ای به نام ماهواره را از بدنه کروموزوم جدا می کند.
مطالعه سازماندهی شیمیایی کروموزوم ها در سلول های یوکاریوتی نشان داده است که آنها عمدتاً از DNA و پروتئین تشکیل شده اند. همانطور که توسط مطالعات متعدد ثابت شده است، DNA حامل مادی خواص وراثت و تنوع است و حاوی اطلاعات بیولوژیکی است - برنامه ای برای توسعه یک سلول یا ارگانیسم که با استفاده از یک کد خاص ثبت شده است. پروتئین ها بخش قابل توجهی از ماده کروموزوم ها را تشکیل می دهند (حدود 65٪ از جرم این ساختارها). کروموزوم به عنوان مجموعه ای از ژن ها یک ساختار تکاملی است که مشخصه همه افراد یک گونه خاص است. موقعیت نسبی ژن ها در یک کروموزوم نقش مهمی در ماهیت عملکرد آنها دارد.
نمایش گرافیکی کاریوتیپ که ویژگیهای ساختاری آن را نشان میدهد، ایدیوگرام نامیده میشود.
مجموعهای از کروموزومها از نظر تعداد و ساختار خاص یک گونه خاص، کاریوتایپ نامیده میشود.
هیستون ها ساختار نوکلئوزومی
هیستون ها دسته اصلی از نوکلئوپروتئین ها هستند، پروتئین های هسته ای که برای مونتاژ و بسته بندی رشته های DNA در کروموزوم ها لازم است. پنج نوع مختلف هیستون وجود دارد که H1/H5، H2A، H2B، H3، H4 نامیده می شوند. توالی اسیدهای آمینه در این پروتئین ها عملاً در ارگانیسم های سطوح مختلف سازمان متفاوت نیست. هیستون ها پروتئین های کوچک و بسیار اساسی هستند که مستقیماً به DNA متصل می شوند. هیستون ها در سازماندهی ساختاری کروماتین شرکت می کنند و گروه های فسفات با بار منفی DNA را به دلیل بارهای مثبت باقی مانده های اسید آمینه خنثی می کنند که بسته بندی متراکم DNA را در هسته ممکن می کند.
دو مولکول هر یک از هیستونهای H2A، H2B، H3 و H4 یک اکتامر را تشکیل میدهند که در اطراف یک قطعه 146 جفت باز از DNA پیچیده شده است که 1.8 دور مارپیچ را در بالای ساختار پروتئین تشکیل میدهد. این ذره با قطر 7 نانومتر نوکلئوزوم نامیده می شود. بخشی از DNA (DNA پیوند دهنده) که در تماس مستقیم با اکتامر هیستون نیست، با هیستون H1 تعامل می کند.
گروه پروتئینهای غیرهیستونی بسیار ناهمگن هستند و شامل پروتئینهای هستهای ساختاری، بسیاری از آنزیمها و فاکتورهای رونویسی مرتبط با بخشهای خاصی از DNA و تنظیم بیان ژن و سایر فرآیندها هستند.
هیستون ها در اکتامر دارای یک قطعه N ترمینال متحرک ("دم") از 20 اسید آمینه هستند که از نوکلئوزوم بیرون زده و برای حفظ ساختار کروماتین و کنترل بیان ژن مهم است. به عنوان مثال، تشکیل (تراکم) کروموزوم ها با فسفوریلاسیون هیستون ها همراه است و افزایش رونویسی با استیلاسیون باقی مانده های لیزین در آنها همراه است. جزئیات مکانیسم نظارتی به طور کامل درک نشده است.
نوکلئوزوم یک زیرواحد کروماتین است که از DNA و مجموعه ای از چهار جفت پروتئین هیستونی H2A، H2B، H3 و H4 از یک مولکول هیستون H1 تشکیل شده است. هیستون H1 به DNA پیوند دهنده بین دو نوکلئوزوم متصل می شود.
نوکلئوزوم واحد بسته بندی اولیه کروماتین است. این شامل یک مارپیچ دوگانه DNA است که به دور مجموعه خاصی از هشت هیستون نوکلئوزومی (هیستون اکتامر) پیچیده شده است. نوکلئوزوم یک ذره دیسکی شکل با قطر حدود 11 نانومتر است که شامل دو نسخه از هر یک از هیستون های نوکلئوزومی (H2A، H2B، H3، H4) است. اکتامر هیستون یک هسته پروتئینی را تشکیل می دهد که DNA دو رشته ای دوبار دور آن پیچیده شده است (146 جفت باز DNA در هر اکتامر هیستون).
نوکلئوزوم های تشکیل دهنده فیبریل ها کم و بیش به طور مساوی در امتداد مولکول DNA در فاصله 10-20 نانومتر از یکدیگر قرار دارند.
سطوح بسته بندی کروموزوم در یوکاریوت ها تراکم کروماتین
بنابراین، سطوح بسته بندی DNA به شرح زیر است:
1) نوکلئوزومی (2.5 چرخش DNA دو رشته ای در اطراف هشت مولکول پروتئین هیستون).
2) سوپرنوکلئوزومی - مارپیچ کروماتین (کرومونما).
3) کروماتید - کرومونما مارپیچی.
4) کروموزوم - درجه چهارم اسپری شدن DNA.
در هسته اینترفاز، کروموزوم ها متراکم شده و توسط کروماتین نشان داده می شوند. ناحیه بدون مارپیچ حاوی ژن، یوکروماتین (کروماتین شل و فیبری) نامیده می شود. این یک پیش نیاز برای رونویسی است. در طول خواب بین تقسیمات، نواحی خاص کروموزوم و کل کروموزوم ها فشرده می مانند.
این نواحی پیچ خورده و بسیار لکه دار، هتروکروماتین نامیده می شود. آنها از نظر رونویسی غیرفعال هستند. هتروکروماتین اختیاری و سازنده وجود دارد.
هتروکروماتین اختیاری آموزنده است زیرا حاوی ژن است و می تواند به یوکروماتین تبدیل شود. از دو کروموزوم همولوگ، یکی ممکن است هتروکروماتیک باشد. هتروکروماتین سازنده همیشه هتروکروماتیک، غیر سازنده (شامل ژن نیست) است و بنابراین همیشه نسبت به رونویسی غیر فعال است.
DNA کروموزومی از بیش از 108 جفت باز تشکیل شده است که از آنها بلوک های اطلاعاتی تشکیل می شود - ژن هایی که به صورت خطی مرتب شده اند. آنها تا 25 درصد از DNA را تشکیل می دهند. یک ژن واحد عملکردی DNA است که حاوی اطلاعاتی برای سنتز پلی پپتیدها یا تمام RNA است. بین ژن ها فاصله دهنده وجود دارد - بخش های DNA غیر اطلاعاتی با طول های مختلف. ژن های اضافی با تعداد زیادی - 104 نسخه یکسان نشان داده می شوند. به عنوان مثال، ژن های t-RNA، r-RNA و هیستون ها هستند. توالی هایی از همان نوکلئوتیدها در DNA وجود دارند. آنها می توانند دنباله هایی نسبتاً تکراری یا بسیار تکرار شونده باشند. توالی های نسبتاً تکرار شونده به 300 جفت نوکلئوتیدی با تکرارهای 102 - 104 می رسند و اغلب نشان دهنده جداکننده ها، ژن های اضافی هستند.
توالی های بسیار تکراری (105 - 106) هتروکروماتین سازنده را تشکیل می دهند. حدود 75 درصد از کل کروماتین در رونویسی دخالت ندارد و شامل توالی های بسیار تکراری و فاصله دهنده های غیر رونویسی شده است.
آماده سازی آماده سازی کروموزومی. استفاده از کلشی سین هیپوتونی، تثبیت و رنگ آمیزی.
بسته به میزان فعالیت تکثیری سلول های بافت های مختلف در داخل بدن و در شرایط آزمایشگاهی، روش های مستقیم و غیر مستقیم برای به دست آوردن آماده سازی کروموزوم ها متمایز می شود.
1) روش های مستقیم در مطالعه بافت هایی با فعالیت میتوزی بالا (مغز استخوان، کوریون و جفت، سلول های غدد لنفاوی، بافت جنینی در مراحل اولیه رشد) استفاده می شود. آماده سازی کروموزومی مستقیماً از مواد تازه به دست آمده پس از پردازش ویژه تهیه می شود.
2) روش های غیرمستقیم شامل تهیه آماده سازی کروموزومی از هر بافتی پس از کشت اولیه آن برای دوره های زمانی مختلف است.
اصلاحات زیادی در روش های مستقیم و غیرمستقیم برای تهیه آماده سازی کروموزوم وجود دارد، اما مراحل اصلی بدست آوردن صفحات متافاز بدون تغییر باقی می مانند:
1. استفاده از کلشی سین (colcemid) - یک مهار کننده تشکیل دوک میتوزی، که تقسیم سلولی را در مرحله متافاز متوقف می کند.
2. شوک هیپوتونیک با استفاده از محلول های نمک های پتاسیم یا سدیم که به دلیل اختلاف فشار اسمزی در داخل و خارج سلول ها باعث متورم شدن آنها و شکستن پیوندهای بین کروموزومی می شود. این روش منجر به جدا شدن کروموزوم ها از یکدیگر می شود و به پراکندگی بیشتر آنها در صفحات متافاز کمک می کند.
3. تثبیت سلول ها با استفاده از اسید استیک یخبندان و اتانول (متانول) به نسبت 3: 1 (تثبیت کننده Carnoy) که به حفظ ساختار کروموزوم کمک می کند.
4. انداختن سوسپانسیون سلولی روی اسلایدهای شیشه ای.
5. رنگ آمیزی آماده سازی کروموزوم.
تعدادی از روشهای رنگآمیزی (باندبندی) برای آشکار کردن مجموعهای از علائم عرضی (راهراهها، نوارها) روی کروموزوم ایجاد شدهاند. هر کروموزوم با مجموعه خاصی از نوارها مشخص می شود. کروموزوم های همولوگ یکسان رنگ آمیزی می شوند، به استثنای نواحی چند شکلی که در آن گونه های آللی مختلف ژن ها موضعی هستند. پلی مورفیسم آللی مشخصه بسیاری از ژن ها است و در اکثر جمعیت ها رخ می دهد. تشخیص پلی مورفیسم در سطح سیتوژنتیک ارزش تشخیصی ندارد.
الف. رنگ آمیزی Q. اولین روش رنگآمیزی افتراقی کروموزومها توسط سیتولوژیست سوئدی Kasperson ساخته شد که از رنگ فلورسنت کینین خردل برای این منظور استفاده کرد. در زیر میکروسکوپ فلورسانس، مناطقی با شدت فلورسانس نابرابر روی کروموزوم ها - بخش های Q قابل مشاهده است. این روش برای مطالعه کروموزومهای Y بسیار مناسب است و بنابراین برای تعیین سریع جنسیت ژنتیکی، تشخیص جابهجایی (تبادل مناطق) بین کروموزومهای X و Y یا بین کروموزوم Y و اتوزومها و همچنین برای مشاهده تعداد زیادی از کروموزومها استفاده میشود. هنگامی که لازم است مشخص شود که آیا بیمار مبتلا به موزائیسم کروموزوم جنسی دارای یک کلون سلولی حاوی کروموزوم Y است یا خیر.
B. رنگ آمیزی G. پس از پیش درمانی گسترده، اغلب با استفاده از تریپسین، کروموزوم ها با رنگ گیمسا رنگ آمیزی می شوند. در زیر میکروسکوپ نوری، نوارهای روشن و تیره روی کروموزوم ها - بخش های G قابل مشاهده است. اگرچه محل قطعات Q با محل قطعات G مطابقت دارد، اما ثابت شده است که رنگ آمیزی G حساس تر است و جای رنگ آمیزی Q را به عنوان روش استاندارد برای تجزیه و تحلیل سیتوژنتیک گرفته است. رنگ آمیزی G برای تشخیص انحرافات کوچک و کروموزوم های نشانگر (تقسیم بندی متفاوت از کروموزوم های همولوگ معمولی) بهترین است.
ب. رنگ آمیزی R تصویری مخالف رنگ آمیزی G می دهد. معمولاً از رنگ فلورسنت نارنجی آکریدین یا لکه گیمسا استفاده می شود. این روش تفاوتهایی را در رنگآمیزی نواحی همولوگ G یا Q منفی کروماتیدهای خواهر یا کروموزومهای همولوگ نشان میدهد.
G. رنگ آمیزی C برای تجزیه و تحلیل نواحی سانترومر کروموزوم ها (این نواحی حاوی هتروکروماتین سازنده هستند) و قسمت دیستال فلورسنت روشن و متغیر کروموزوم Y استفاده می شود.
E. رنگ آمیزی T برای تجزیه و تحلیل مناطق تلومری کروموزوم ها استفاده می شود. این تکنیک و همچنین رنگ آمیزی نواحی سازمان دهنده هسته با نیترات نقره (رنگ آمیزی AgNOR)، برای شفاف سازی نتایج به دست آمده از رنگ آمیزی کروموزوم استاندارد استفاده می شود.
سنتز پیش سازهای rRNA و tRNA مشابه سنتز ire-mRNA است. رونوشت اولیه RNA ریبوزومی حاوی اینترون نیست، و تحت عمل RNaseهای خاص از آن جدا می شود و 28S-، 18S- و 5.8S-rRNA را تشکیل می دهد. 5S-pRNA با مشارکت RNA پلیمراز III سنتز می شود.
rRNA و tRNA.
رونوشت های tRNA اولیه نیز با هیدرولیز جزئی به اشکال بالغ تبدیل می شوند.
همه انواع RNA در بیوسنتز پروتئین نقش دارند، اما عملکرد آنها در این فرآیند متفاوت است. نقش ماتریکسی که ساختار اولیه پروتئین ها را تعیین می کند توسط RNA پیام رسان (mRNA) انجام می شود. استفاده از سیستم های بیوسنتز پروتئین بدون سلول برای مطالعه مکانیسم های ترجمه مهم است. اگر هموژنه های بافت با مخلوطی از اسیدهای آمینه، که حداقل یکی از آنها نشاندار شده است، انکوبه شوند، می توان بیوسنتز پروتئین را با گنجاندن برچسب در پروتئین ها تشخیص داد. ساختار اولیه پروتئین در حال سنتز توسط ساختار اولیه mRNA اضافه شده به سیستم تعیین می شود. اگر سیستم بدون سلول از mRNA گلوبین تشکیل شده باشد (می توان آن را از رتیکولوسیت ها جدا کرد)، اگر آلبومین با mRNA آلبومین جدا شده از سلول های کبدی و غیره سنتز شود، گلوبین (زنجیره های a- و 3-globin) ساخته می شود.
14. معنی تکرار:
الف) فرآیند یک مکانیسم مولکولی مهم است که زیربنای انواع تقسیم سلولی در پروئوکاریوت ها است، ب) انواع تولید مثل موجودات تک سلولی و چند سلولی را تضمین می کند.
ج) ثبات سلولی را حفظ می کند
ترکیب اندام ها، بافت ها و بدن در نتیجه بازسازی فیزیولوژیکی
د) وجود طولانی مدت افراد خاص را تضمین می کند.
ه) وجود طولانی مدت گونه های موجودات را تضمین می کند.
و) این فرآیند باعث افزایش دو برابری دقیق اطلاعات می شود.
g) خطاها (جهش) در طول فرآیند تکثیر ممکن است، که می تواند منجر به اختلال در سنتز پروتئین با ایجاد تغییرات پاتولوژیک شود.
خاصیت منحصر به فرد مولکول DNA برای تکثیر شدن خود قبل از تقسیم سلولی، همانندسازی نامیده می شود.
خواص ویژه DNA بومی به عنوان حامل اطلاعات ارثی:
1) تکرار - تشکیل زنجیره های جدید مکمل است.
2) خود تصحیح - DNA پلیمراز بخش هایی را که به اشتباه تکرار شده اند جدا می کند (10-6).
3) جبران - ترمیم.
این فرآیندها در سلول با مشارکت آنزیم های خاص رخ می دهد.
نحوه عملکرد سیستم ترمیم آزمایشاتی که امکان شناسایی مکانیسم های ترمیم و وجود این توانایی را فراهم می کند با استفاده از موجودات تک سلولی انجام شد. اما فرآیندهای ترمیم در سلول های زنده حیوانات و انسان ها ذاتی هستند. برخی از افراد از گزرودرما پیگمنتوزوم رنج می برند. این بیماری به دلیل عدم توانایی سلول ها در سنتز مجدد DNA آسیب دیده ایجاد می شود. زیرادرما ارثی است. سیستم جبران خسارت از چه چیزی تشکیل شده است؟ چهار آنزیم که فرآیند ترمیم را پشتیبانی می کنند عبارتند از DNA هلیکاز، اگزونوکلئاز، پلیمراز و لیگاز. اولین مورد از این ترکیبات قادر به تشخیص آسیب در زنجیره مولکول اسید دئوکسی ریبونوکلئیک است. این نه تنها تشخیص می دهد، بلکه زنجیره را در محل مناسب برای حذف بخش اصلاح شده مولکول برش می دهد. خود حذف با استفاده از DNA اگزونوکلئاز انجام می شود. در مرحله بعد، بخش جدیدی از مولکول اسید دئوکسی ریبونوکلئیک از اسیدهای آمینه سنتز می شود تا به طور کامل جایگزین بخش آسیب دیده شود. خوب، آکورد نهایی این پیچیده ترین روش بیولوژیکی با استفاده از آنزیم DNA لیگاز انجام می شود. مسئول اتصال محل سنتز شده به مولکول آسیب دیده است. هنگامی که هر چهار آنزیم کار خود را انجام دادند، مولکول DNA به طور کامل تجدید می شود و تمام آسیب ها متعلق به گذشته است. به این ترتیب مکانیسم های درون یک سلول زنده به طور هماهنگ کار می کنند.
طبقه بندی در حال حاضر، دانشمندان انواع زیر را از سیستم های جبران خسارت تشخیص می دهند. آنها بسته به عوامل مختلف فعال می شوند. این موارد عبارتند از: فعال سازی مجدد. ترمیم نوترکیبی تعمیر هترودپلکس. ترمیم اکسیزیون. اتحاد مجدد انتهای غیر همولوگ مولکول های DNA. همه موجودات تک سلولی حداقل دارای سه سیستم آنزیمی هستند. هر کدام از آنها توانایی انجام فرآیند بازیابی را دارند. این سیستم ها عبارتند از: مستقیم، اکسیزیون و پس از تکثیر. پروکاریوت ها دارای این سه نوع ترمیم DNA هستند. در مورد یوکاریوت ها، آنها مکانیسم های اضافی به نام Miss-mathe و Sos-repair را در اختیار دارند. زیست شناسی همه این انواع خودترمیمی مواد ژنتیکی سلول ها را به تفصیل مطالعه کرده است.
15. کد ژنتیکی روشی برای رمزگذاری توالی اسید آمینه پروتئین ها با استفاده از دنباله ای از نوکلئوتیدها است که مشخصه همه موجودات زنده است. توالی اسید آمینه در یک مولکول پروتئین به عنوان یک توالی نوکلئوتیدی در یک مولکول DNA رمزگذاری شده و نامیده می شود. کد ژنتیکی.بخشی از یک مولکول DNA که مسئول سنتز یک پروتئین است نامیده می شود ژنوم
DNA از چهار نوکلئوتید استفاده می کند - آدنین (A)، گوانین (G)، سیتوزین (C)، تیمین (T) که در ادبیات روسی با حروف A، G، C و T مشخص شده اند. این حروف الفبای الفبای را تشکیل می دهند. کد ژنتیکی. RNA از همان نوکلئوتیدها استفاده می کند، به استثنای تیمین، که با یک نوکلئوتید مشابه - اوراسیل جایگزین می شود که با حرف U (U در ادبیات روسی) مشخص می شود. در مولکولهای DNA و RNA، نوکلئوتیدها به صورت زنجیرهای قرار میگیرند و به این ترتیب، دنبالهای از حروف ژنتیکی بهدست میآیند.
برای ساخت پروتئین در طبیعت از 20 اسید آمینه مختلف استفاده می شود. هر پروتئین یک زنجیره یا چندین زنجیره از اسیدهای آمینه در یک توالی کاملاً مشخص است. این توالی ساختار پروتئین و در نتیجه تمام خواص بیولوژیکی آن را تعیین می کند. مجموعه ای از اسیدهای آمینه نیز تقریباً برای همه موجودات زنده جهانی است.
پیاده سازی اطلاعات ژنتیکی در سلول های زنده (یعنی سنتز پروتئین کدگذاری شده توسط یک ژن) با استفاده از دو فرآیند ماتریکس انجام می شود: رونویسی (یعنی سنتز mRNA روی ماتریس DNA) و ترجمه کد ژنتیکی. به یک توالی اسید آمینه (سنتز یک زنجیره پلی پپتیدی بر روی یک ماتریس mRNA). سه نوکلئوتید متوالی برای رمزگذاری 20 اسید آمینه و همچنین سیگنال توقف نشان دهنده پایان دنباله پروتئین کافی است. به مجموعه ای از سه نوکلئوتید سه گانه می گویند. اختصارات پذیرفته شده مربوط به اسیدهای آمینه و کدون ها در شکل نشان داده شده است.
ویژگی های کد ژنتیکی
سه گانه - یک واحد معنی دار کد ترکیبی از سه نوکلئوتید (سه گانه یا کدون) است.
تداوم - بین سه قلوها علامت گذاری وجود ندارد، یعنی اطلاعات به طور مداوم خوانده می شود.
عدم همپوشانی - یک نوکلئوتید نمی تواند به طور همزمان بخشی از دو یا چند سه قلو باشد. (در مورد برخی از ژنهای همپوشانی در ویروسها، میتوکندریها و باکتریهایی که پروتئینهای تغییر قاب چندگانه را کد میکنند، صادق نیست.)
منحصر به فرد بودن - یک کدون خاص تنها با یک اسید آمینه مطابقت دارد. (این ویژگی جهانی نیست. کدون UGA در Euplotes crassus دو اسید آمینه - سیستئین و سلنوسیستئین را رمزگذاری می کند)
انحطاط (زیادی) - چندین کدون می توانند با یک اسید آمینه مشابه مطابقت داشته باشند.
جهانی بودن - کد ژنتیکی در موجودات با سطوح مختلف پیچیدگی یکسان عمل می کند - از ویروس ها گرفته تا انسان ها (روش های مهندسی ژنتیک بر این اساس است) (همچنین تعدادی استثنا برای این ویژگی وجود دارد، جدول را در "تغییرات کد ژنتیک استاندارد» در این مقاله).
16.شرایط بیوسنتز
بیوسنتز پروتئین به اطلاعات ژنتیکی از مولکول DNA نیاز دارد. RNA پیام رسان - حامل این اطلاعات از هسته تا محل سنتز. ریبوزوم ها - اندامک هایی که سنتز پروتئین در آنها اتفاق می افتد. مجموعه ای از اسیدهای آمینه در سیتوپلاسم؛ انتقال RNA هایی که اسیدهای آمینه را رمزگذاری می کنند و آنها را به محل سنتز روی ریبوزوم منتقل می کند. ATP ماده ای است که انرژی را برای فرآیند رمزگذاری و بیوسنتز فراهم می کند.
مراحل
رونویسی- فرآیند بیوسنتز انواع RNA در ماتریس DNA که در هسته اتفاق می افتد.
بخش خاصی از مولکول DNA از بین می رود، پیوندهای هیدروژنی بین دو زنجیره تحت تأثیر آنزیم ها از بین می روند. در یک رشته DNA، مانند یک الگو، یک کپی RNA از نوکلئوتیدها مطابق با اصل مکمل سنتز می شود. بسته به بخش DNA، RNA های ریبوزومی، حمل و نقل و پیام رسان به این روش سنتز می شوند.
پس از سنتز mRNA، از هسته خارج شده و به سیتوپلاسم فرستاده می شود و به محل سنتز پروتئین روی ریبوزوم می رسد.
پخش- فرآیند سنتز زنجیره های پلی پپتیدی که بر روی ریبوزوم ها انجام می شود، جایی که mRNA یک واسطه در انتقال اطلاعات در مورد ساختار اولیه پروتئین است.
بیوسنتز پروتئین شامل یک سری واکنش است.
1. فعال سازی و کدگذاری اسیدهای آمینه. tRNA به شکل یک برگ شبدر است که در حلقه مرکزی آن یک آنتی کدون سه گانه وجود دارد که مربوط به کد یک اسید آمینه خاص و کدون موجود در mRNA است. هر اسید آمینه با استفاده از انرژی ATP به tRNA مربوطه متصل می شود. یک کمپلکس tRNA-اسید آمینه تشکیل می شود که وارد ریبوزوم ها می شود.
2. تشکیل کمپلکس mRNA-ریبوزوم. mRNA موجود در سیتوپلاسم توسط ریبوزوم در ER گرانول متصل می شود.
3. مونتاژ زنجیره پلی پپتیدی. tRNA با اسیدهای آمینه، طبق اصل مکمل بودن آنتی کدون-کدون، با mRNA ترکیب شده و وارد ریبوزوم می شود. در مرکز پپتیدی ریبوزوم، یک پیوند پپتیدی بین دو اسید آمینه تشکیل می شود و tRNA آزاد شده از ریبوزوم خارج می شود. در این حالت، mRNA هر بار یک سه گانه پیش می رود، یک tRNA جدید - یک اسید آمینه معرفی می کند و tRNA آزاد شده را از ریبوزوم حذف می کند. کل فرآیند توسط انرژی ATP تامین می شود. یک mRNA می تواند با چندین ریبوزوم ترکیب شود و یک پلی زومی را تشکیل دهد، جایی که بسیاری از مولکول های یک پروتئین به طور همزمان سنتز می شوند. سنتز زمانی به پایان می رسد که کدون های بی معنی (کدهای توقف) روی mRNA شروع شوند. ریبوزوم ها از mRNA جدا می شوند و زنجیره های پلی پپتیدی از آنها جدا می شوند. از آنجایی که کل فرآیند سنتز روی شبکه آندوپلاسمی دانه ای انجام می شود، زنجیره های پلی پپتیدی حاصل وارد لوله های ER می شوند، جایی که ساختار نهایی خود را به دست می آورند و به مولکول های پروتئین تبدیل می شوند.
تمام واکنش های سنتز توسط آنزیم های ویژه با صرف انرژی ATP کاتالیز می شوند. سرعت سنتز بسیار زیاد است و به طول پلی پپتید بستگی دارد. به عنوان مثال، در ریبوزوم اشریشیا کلی، پروتئینی متشکل از 300 اسید آمینه در حدود 15 تا 20 ثانیه سنتز می شود.